La Asociación Internacional para el Estudio del Dolor (IASP) define el dolor como: "una experiencia sensorial y emocional desagradable asociada con una lesión tisular real o potencial, o que se describe como ocasionada por dicha lesión". Esta definición aceptada de forma universal considera en primer lugar que el dolor no es una experiencia puramente nociceptiva (sensorial), sino que incluye además componentes emocionales y subjetivos inseparables de la sensación dolorosa; en segundo lugar esta definición evita decir claramente que el dolor está producido únicamente por el daño tisular, pudiendo aparecer sin causa somática que lo justifique.
La diferenciación entre dolor agudo y crónico se basa tanto en el factor tiempo, como en los mecanismos fisiopatológicos que originan el dolor. El dolor agudo es la consecuencia inmediata de la activación de los sistemas nociceptivos; se manifiesta generalmente después de una lesión tisular, se autolimita y desaparece con la lesión que lo originó. Tiene una función de protección biológica al actuar como una señal de “alarma” a nivel del tejido lesionado.
Los síntomas psicológicos asociados son escasos y habitualmente limitados a una ansiedad leve. Se trata de un dolor de naturaleza nociceptiva y que aparece por una estimulación química, mecánica o térmica de nociceptores específicos.
El dolor crónico, sin embargo, no posee una función protectora, y más que un síntoma de una lesión, puede considerarse en sí mismo una enfermedad. Se ha definido como un dolor que persiste al menos un mes después de la lesión causal, pudiendo perpetuarse por un periodo de tiempo prolongado después de dicha lesión e incluso en ausencia de lesión periférica. El dolor crónico suele ser refractario a múltiples tratamientos y está asociado a numerosos síntomas psicológicos: depresión, ansiedad, miedo, insomnio y alteraciones del comportamiento, en especial de las relaciones sociales.
FISIOPATOLOGIA DEL DOLOR AGUDO:
Un estímulo intenso sobre la piel normal produce una reacción triple:
1. ENROJECIMIENTO: En la zona de la estimulación.
2. REACCION ERITEMATOSA: Rodea a la anterior y se debe a dilatación arterial.
3. EDEMA LOCAL: Secundario al incremento de la permeabilidad vascular.
En esta respuesta intervienen muchas sustancias con papel importante, algunas se liberan a partir de la estructura tisular lesionada, como el potasio, la histamina, las prostaglandinas y la serotonina, otras proceden de la circulación como las bradicininas o de las propias terminaciones nerviosas como la sustancia P. Algunas de estas sustancias activan las terminaciones nerviosas libres, pudiendo explicarse parcialmente la hipersensibilidad residual en esa zona de la piel afectada por un estímulo nocivo, debido a un efecto de largo plazo.
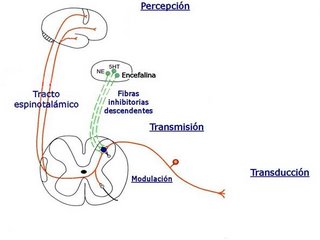
Las vías analgésicas descendentes suprimirían los estímulos nociceptivos. En los animales de experimentación, la estimulación eléctrica de la sustancia gris periacueductal mesencefálica puede producir una analgesia generalizada sin otras respuestas sensitivas ni motoras evidentes, en el ser humano puede existir un sistema similar, y se ha señalado que la estimulación de la sustancia gris periventricular alivia el dolor clínico, Este efecto parece estar mediado al menos en parte a nivel medular, debido a que puede ser bloqueado en animales de experimentación al seccionar las vías que contienen las proyecciones descendentes desde el tronco hasta el asta posterior, no obstante, algunas neuronas periacueductales se proyectan directamente hacia la médula espinal.
Los núcleos grises periacueductales, el rafe bulbar y el asta posterior contienen una elevada densidad de péptidos opiáceos endógenos y de receptores opiáceos, en parte, los analgésicos narcóticos sistémicos actúan activando el sistema analgésico descendente en estas zonas. Hay una elevada densidad de receptores opiáceos en otras regiones, por ejemplo en el tálamo medial y en la parte prosencefálica del sistema límbico. Estas estructuras pueden desempeñar un papel adicional importante en la respuesta analgésica (y también en el potencial de adicción) frente a los narcóticos administrados por vía sistémica.
Las aminas biógenas representan a otra clase de neurotransmisores que han sido observados en las vías descendentes que modulan la nocicepción. La serotonina existe en muchas de las neuronas del rafe que finalizan en el asta posterior, y algunas terminales axonales serotoninérgicas finalizan directamente en las neuronas del haz espinotalámico; una vía inhibidora descendente importante que contiene noradrenalina también se origina en el locus coeruleus situado en la protuberancia, este sistema parece inhibir las respuestas nociceptivas de las neuronas del asta posterior a través de un mecanismo alfa adrenérgico.
Los fármacos que potencian los efectos centrales de las aminas biógenas, como los antidepresivos tricíclicos, pueden por tanto producir una analgesia eficaz debido a que potencian los efectos de estas vías descendentes.
Llamado también “anormal” o “patológico”, aparece en una minoría de individuos y es el resultado de una lesión y alteración de la transmisión de la información nociceptiva a nivel del Sistema Nervioso Periférico (SNP) o Central (SNC). En este caso no existe relación causal entre la lesión tisular y el dolor. Una de sus principales características es la presencia de alodinia (podríamos decir que es prácticamente patognomónica), es decir la aparición de dolor frente a estímulos que habitualmente no son dolorosos; así por ejemplo en pacientes con neuralgia post-herpética, el roce de las sabanas sobre la zona afectada, produce dolor. Otros ejemplos de dolor neuropático son las radiculopatías, la neuralgia del trigémino, el dolor de miembro fantasma, los síndromes de dolor regional complejo y distintas neuropatías periféricas (diabética, urémica).
El dolor nociceptivo y el dolor neuropático representan los dos extremos de una amplia sucesión de eventos que se integran a nivel del sistema nervioso3-5. En condiciones fisiológicas existe un equilibrio entre lesión y dolor; sin embargo, estímulos nociceptivos muy intensos, prolongados o repetitivos, inducen alteraciones en este equilibrio dando lugar a variaciones en la intensidad y duración de las respuestas nociceptivas. Estos cambios son habitualmente temporales ya que el sistema tiende a restaurar el equilibrio, pero en algunos pacientes aparecen cambios persistentes en la integración de la información nociceptiva y como consecuencia, se pierde toda relación entre lesión tisular y dolor.
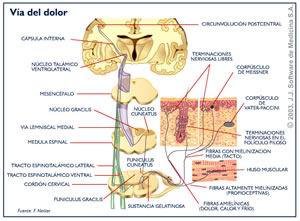
En base a las características del estimulo nociceptivo y la respuesta al mismo, se han descrito tres fases o tipos de dolor, que se producen por mecanismos neurofisiológicos diferentes. El dolor de “fase 1” es aquel que aparece tras un estímulo nocivo breve, señala o indica la presencia de una lesión tisular y es una sensación necesaria para la supervivencia del individuo. Las vías y mecanismos de transmisión implicados pueden sufrir una modulación inhibitoria a distintos niveles, hasta alcanzar la corteza cerebral. En esta fase existe una correlación estrecha entre los cursos temporales del estímulo nocivo y la sensación dolorosa.
El dolor de la “fase 2” aparece como respuesta a estímulos prolongados que producen lesión tisular e inician procesos inflamatorios y muestra la capacidad de respuesta o “adaptación” del sistema nervioso frente a una agresión que requiere un proceso de curación y cicatrización. El mecanismo de transmisión de este tipo de dolor es distinto al de “fase 1”, ya que la transmisión nociceptiva experimenta dos cambios importantes. Por una parte, la presencia de factores titulares liberados por el proceso inflamatorio causa una sensibilización de los nociceptores periféricos, lo que produce una disminución del umbral de excitación y un aumento de las descargas de las vías aferentes. Estos cambios originan a nivel del SNC, un aumento de la excitabilidad neuronal y la puesta en marcha de mecanismos de amplificación de las respuestas. Como consecuencia, se pierde la estrecha correlación entre la intensidad del estímulo y magnitud de la respuesta (dolor), persistiendo el dolor aun en ausencia de nueva lesión tisular.
Los dolores de la “fase 3” corresponden a estados dolorosos anormales, debidos generalmente a lesiones de los nervios periféricos o del SNC y se caracterizan por la falta de relación entre lesión y dolor. Los dolores de las “fases 1 y 2” son debidos a estímulos nocivos de corta duración o a lesiones periféricas, mientras que los dolores de “fase 3” son síntoma de enfermedad neurológica y aparecen como dolores espontáneos provocados por estímulos inocuos o dolores intensos ante estímulos nocivos de baja intensidad. En esta fase el sistema nociceptivo se comporta de forma anómala ya sea por alteraciones intrínsecas a nivel del SNC o por descargas repetidas de origen periférico. Teniendo en cuenta que el dolor nociceptivo y el dolor neuropático tienen un procesamiento diferente, las actitudes terapéuticas que se utilizan son también distintas, aunque en ambos casos se intentan prevenir los cambios a nivel del SNC (característicos de las “fases 2 y 3”) que puedan aparecer como consecuencia de la lesión periférica.
Estas sustancias se hallan en todos los tejidos de los mamíferos y líquidos biológicos, son halladas en casi todas las células del organismo, a excepción de los glóbulos rojos.
Las diferentes prostaglandinas se diferencian solamente por pequeños cambios en la metilación u oxidación de sus cadenas carbonadas.
La designación de PGE1, PGE2 y PGE3, se refiere únicamente a la presencia de mayor o menor numero de enlaces dobles en la cadena lateral alifática. Las PG2s son las más abundantes en la naturaleza.
Se cree que la mayoría de los ácidos grasos esenciales que entran en la alimentación son incorporados dentro de los fosfolípidos, después de lo cual, por medio de un estímulo apropiado, la Fosfolipasa A es activada trayendo consigo la liberación de los ácidos grasos esenciales, especialmente el ácido araquidónico, hecho que inicia la formación de las PGs.
En el hombre, el precursor más importante de las prostaglandinas es el ácido araquidónico, el cual se forma del ácido linoléico.
El metabolismo del ácido araquidónico se realiza por un complejo enzimático llamado la PG sintetasa, de localización microsomal, compuesto de una serie de enzimas con actividades diferentes: la peroxidasa, la ciclooxigenasa, la isomerasa, la TXsintetasa y las enzimas desdobladoras.
Una vez que las prostaglandinas son sintetizadas en los tejidos comienzan su acción a nivel local, produciendo importantes cambios funcionales, posteriormente siendo distribuidas sistemáticamente por vía venosa y muchas de ellas metabolizadas en el pulmón.
El estímulo a la síntesis y la secreción de las prostaglandinas son múltiples, el estímulo neural, la hipoxemia, la serotonina, la acetil-colina, la histamina, la norepinefrina, la angiotensina II y las bradicininas. La acción de las PGs no es específica, ya que una misma prostaglandina puede estimular determinadas funciones e inhibir otras.La acción de las prostaglandinas está relacionada con cambios en el AMP cíclico; en unos sistemas la misma prostaglandina es capaz de estimular la adenil ciclasa, caso en el cual estimula la función celular y en otros es capaz de inhibirla, manifestándose por depresión de sus funciones. La intensidad de acción de diferentes prostaglandinas sobre la adenil ciclasa no es igual. Las acciones biológicas de las prostaglandinas son tan variadas que ningún compuesto natural de los hasta ahora estudiados las iguala.